Преимущества применения аммонизации при водоподготовке
Обоснование необходимости аммонизации воды
Введение хлора в содержащую органические вещества природную воду в процессе водоподготовки приводит к образованию хлорорганических соединений (ХОС) первого класса опасности и вызывает появление специфических хлорных запахов и привкусов.
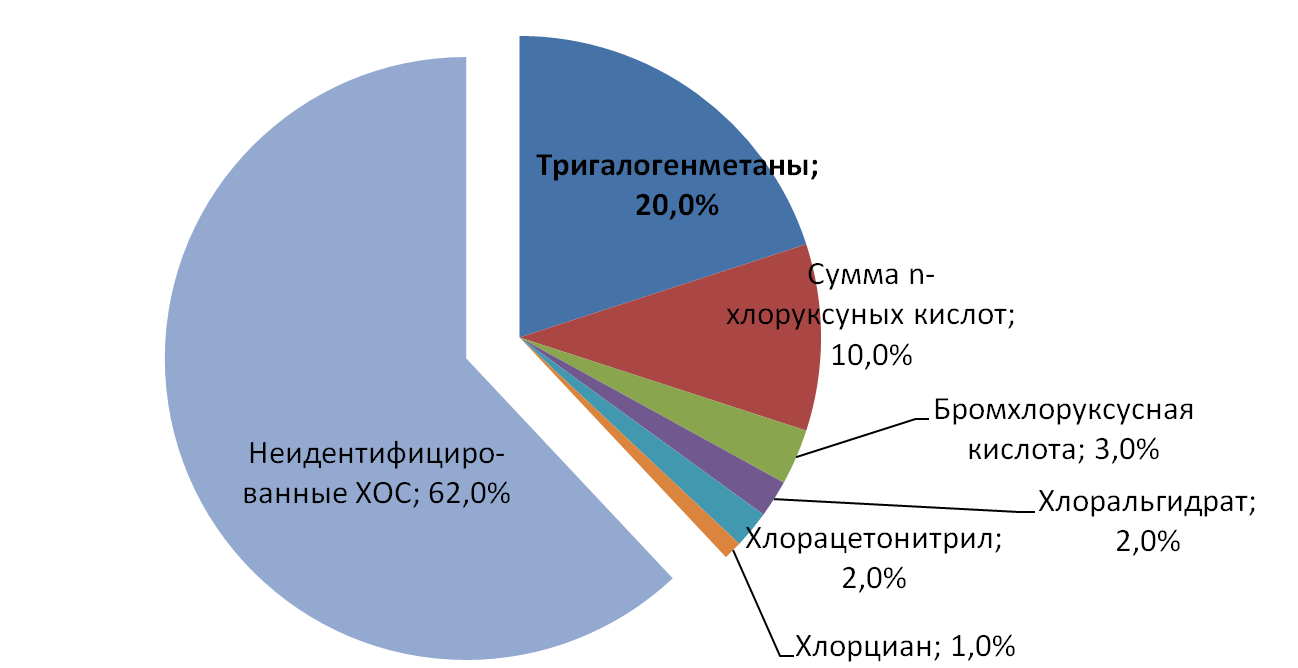
Рис. 1. Производные хлорирования воды
Диаграмма составлена по: Richardson, S. D. (2003) Disinfection By-Products and Other Emerging Contaminants in Drinking Water. Trends in Analytical Chemistry, 22(10): 666-684.
Индикаторным веществом – продуктом хлорирования воды – является хлороформ (трихлорметан), являющийся основным компонентом группы тригалогенметанов, к которым также относятся бромдихлорметан, дибромхлорметан и бромоформ. Также хлороформ является основным индивидуальным веществом-хлорпроизводным, что делает его наиболее удобным ХОС для проведения рутинного анализа. Хотя сумма всех остальных хлорорганических соединений (не хлороформа) составляет более 80 % от общего количества хлорпроизводных, но индивидуально каждое из них образуется в меньших количествах, чем хлороформ, поэтому определяют чаще всего именно его.
Хлороформ, как и ряд других производных хлорирования воды, в силу своего метаболического пути гепатотоксичен и рассматривается как потенциальный канцероген. МАИР – Международное агентство по изучению рака (IARC или CIRC) относит хлороформ и четыреххлористый углерод к категории 2Б «вероятно канцерогенные для человека» (2В – The agent (mixture) is possibly carcinogenic to humans. The exposure circumstance entails exposures that are possibly carcinogenic to humans.). Федеральное агентство США USEPA также характеризует хлороформ формулировкой «вероятно является канцерогеном при определенных дозах» (L/N grade – likely to be carcinogenic above a specified dose, but not below). Канцерогенное действие хлороформа проявляется его основным метаболитом – фосгеном, хлороформ метаболизирует в печени до фосгена, который разлагается с образованием свободных неаутогенных радикалов, являющихся канцерогенными факторами. Другие хлорпроизводные имеют несколько иные механизмы токсичности, например, галогенуксусные кислоты приводят к гипометилированности ДНК, что является нормальным возрастным фактором опухолеобразования (это нормальное возрастное изменение ДНК человека, но мало кто захочет приближать свою смерть от возрастного онкологического заболевания).
В таблице 1 приведено допустимое содержание хлороформа в питьевой воде по различным международным и российским нормам.
Таблица 1. Лимиты содержания хлороформа в питьевой воде
| Страна/организация | Наименование нормативного акта | Содержание хлороформа, мкг/дм3 |
| ВОЗ (Всемирная организация здравоохранения) | Guidelines for drinking-water quality First addendum to third edition Volume 1 Recommendations 2006 | 300 |
| USEPA (США) (United States Environmental protection agency) | Drinking water standards and health advisories table 2009 | 80 |
| Российская Федерация | СанПиН 2.1.4.1074-01 | 200 |
| Российская Федерация | ГН 2.1.5.1315-03 | 100 |
| Российская Федерация | ГН 2.1.5.2280-07 | 60 |
Красным в таблице 1 выделен норматив, действующий в РФ повсеместно. Желтым выделен ГН, ограничения которого вводятся территориальными надзорными органами добровольно или принудительно только в некоторых регионах России, например, они действуют в Москве и Санкт-Петербурге. В любом случае очевидна тенденция ужесточения требований к предельным концентрациям ХОС в питьевой воде.
Образование запаховых хлорпроизводных
Запах хлора ощущается даже при минимальном, нормативном, содержании в воде активного хлора в 0,3 – 0,4 мг/дм3. А если в исходной воде содержатся некоторые вещества, например фенолы, введение в нее хлора вызывает появление несоизмеримо более сильных неприятных запахов и привкусов (т.н. хлорфенольных запахов), которые проявляются уже при микрограммовых концентрациях.
Инфекционная безопасность воды стоит на первом месте, а хлорирование является практически безальтернативным по своей универсальности методом основного обеззараживания воды. Все остальные методы обеззараживания имеют те или иные ограничения, например, по отсутствию продлённого действия - как озонирование или ультрафиолетовое облучение, или по своим производным - как у диоксида хлора или того же озона. Поэтому они не являются основными, а призваны содействовать хлорированию в некоторых отдельных случаях, как и в случае УФО. Поскольку хлорирование воды безальтернативно, то снижение образования ХОС от хлорирования является актуальной научно-практической и технологической задачей.
Способы снижения содержания хлорорганических производных
Снижение содержания ХОС в производимой питьевой воде возможно тремя способами:
1. Доочистка воды от уже образовавшихся ХОС сорбционными методами – фильтрацией через гранулированный активированный уголь (ГАУ) либо добавлением порошкового активированного угля (ПАУ) перед вторичной обработкой воды (фильтрацией при двухступенной технологической схемой водоподготовки). Снижение расходов хлора и снижение изначального образования ХОС при этой тактике удаления нежелательных веществ не происходит.
Сорбционный метод борьбы с хлорорганическими производными имеет следующие ограничения:
• Высокая стоимость гранулированного и порошкового активированных углей (ГАУ и ПАУ). ПАУ применяется «одноразово» и удаляется при промывке фильтров, а ГАУ необходимо загружать в фильтры в достаточно большом количестве. Для обеспечения времени контакта воды с ГАУ не менее 5 минут, при скорости фильтрации 6 м/ч и межзерновой порозности в 35%, слой загрузки ГАУ должен составлять 1,5 м.
• Ограниченная сорбционная емкость ГАУ с необходимостью его периодической замены. Слой ГАУ мог бы служить достаточно продолжительное время, но его сорбционная активность падает не только из-за накопления сорбата ХОС, но и из-за кольматации пор остаточными неотмываемыми загрязнениями и продуктами гидролиза коагулянтов. Такой способ борьбы с ХОС в промышленных масштабах используется редко, но зато активно практикуется населением, приобретающим угольные фильтрующие системы.
2. Отказ от первичного хлорирования и максимальное удаление интенсивными методами очистки находящихся в природной воде органических веществ – прекурсоров ХОС. При этом достигается не менее чем двукратное сокращение расходов хлора и двух-трехкратное снижение образования хлорорганических веществ.
Данный метод борьбы с хлорорганическими производными имеет следующие ограничения:
• Отказ от первичного хлорирования не всегда возможен по исходным микробиологическим показателям воды даже с проведением периодической обработки сооружений гиперхлорированием.
• Очень глубокое удаление органических веществ до значений перманганатной окисляемости в 2-3 мг/л не всегда достижимо и относительно затратно.
• Остающееся необходимым вторичное хлорирование очищенной воды перед её поступлением в резервуар чистой воды также приводит к образованию ХОС, хоть и в значительно меньшей степени.
3. Снижение реакционной способности хлора за счет его связывания в промежуточные соединения. Эти соединения обладают меньшей чем у хлора окислительной способностью и почти не образуют хлорпроизводных, но всё же их активности достаточно для эффективного обеззараживания. К таким веществам относятся N-хлорзамещенные соединения со связью азот-хлор. Примеры таких веществ – дихлоризоциануровая и трихлоризоциануровая кислоты, применяемые для обеззараживания воды в бассейнах под торговыми названиями Дихлор и Трихлор. Самое простое подобное вещество, широко применяемое в санитарии – это монохлорамин. При этом монохлорамин, в отличие от других N-Cl соединений, может образовываться непосредственно в обрабатываемой воде из исходных веществ – солей аммония и водного хлора (хлорноватистой кислоты). В коммунальной водоподготовке способ обеззараживания воды хлорамином, образующимся при аммонизации воды перед хлорированием, как раз и находит широкое применение.
Аспекты хлораммонизации воды
Для образования в воде хлорамина проводят аммонизацию воды, т. е. вводят в воду или сжиженный аммиак, или аммиачную воду, или аммонийную соль – сульфат аммония.
При этом возможны 2 варианта аммонизации воды:
• Для обеспечения более длительного бактерицидного действия хлора, а также для предотвращения появления в воде ХОС, запахов и привкусов применяют предварительную аммонизацию, т.е. водный аммиак или сульфат аммония вводят в воду раньше хлора.
• Для борьбы только с хлорными запахами и привкусами, но без существенного снижения образования ХОС и снижения расходов хлора, водный аммиак или сульфат аммония вводят в воду позже хлора, перед поступлением воды в резервуары чистой воды.
При проведении предварительной аммонизации достигается ориентировочное сокращение расходов хлора в 1,5 – 2 раза и снижение образования ХОС в 2 – 3 раза. Поскольку при этом не происходит отказ от первичного обеззараживания (как это описывалось во втором способе снижения уровня ХОС выше), то это позволяет поддерживать удовлетворительное санитарное состояние очистных сооружений.
При проведении аммонизации химические процессы хлорирования воды протекают несколько иначе. При наличии в воде ионов аммония активный хлор взаимодействует не только с органическими загрязнениями воды, что вызывает проблемы хлорпроизводных, привкусов и запахов, но в большей степени с аммоний-ионами. При взаимодействии водного аммиака или сульфата аммония с хлорноватистой кислотой НОСl, образующейся при хлорировании воды хлором или гипохлоритом натрия, образуется монохлорамин или просто хлорамин по реакции (1). Теоретически, возможно протекание более глубокого хлорирования аммонийного азота по реакциям (2) и (3), что иногда указывается в отечественной литературе по водоподготовке, но в реальности эти реакции не протекают или почти не протекают:
NH4OH + НСlО ↔ NH2Сl + 2Н2О монохлорамин (1)
NH2Сl + НСlО ↔ NHСl2 + Н2О дихлорамин (2)
NHСl2 + НСlО ↔ NСl3 + Н2О хлористый азот (3)
Для реакции (1) равновесие сильно смещено в сторону образования хлорамина (рК = 9,6). Обеззараживание воды происходит за счет окислительной способности хлорамина, которая ниже, чем у хлора. Таким образом, аммонизация ослабляет бактерицидное действие хлора, но за счет меньшей химической активности хлораминов существенно удлиняет период этого действия.
По данным некоторых авторов, например, J.C.Morris, Future of chlorination. J. Am. Water Works Assoc. 1966, № 58, стр. 1475–1482 (Будущее хлорирования. Журнал ассоциации водоснабжения США, 1966 год), средняя биоцидная активность монохлорамина оценивается в 0,4% от активности хлорноватистой кислоты HClO.
Действующее руководство ВОЗ по питьевой воде (World Health Organization. Guidelines for drinking-water quality. Incorporating first addendum. Vol. 1, Recommendations. – 3-rd ed. 2006. Table 7.6. Page 140) оценивает обеззараживающее действие водного хлора (гипохлорит-иона и хлорноватистой кислоты) и монохлорамина следующим образом (таблица 2):
Таблица 2. Эффективность 99%-го (Log = 2,0) обеззараживания водным хлором и монохлорамином
| Группы патогенов | Хлор (C*t99) | Монохлорамин (C*t99) |
| Бактерии | 0,08 мг*мин./дм3 при Т = 1°C и pH = 7,0 лог.ед.; 3,3 мг*мин./дм3 при Т = 1°C и pH = 8,5 лог.ед. | 94 мг*мин./дм3 при Т = 1°C и pH = 7,0 лог.ед.; 278 мг*мин./дм3 при Т = 1°C и pH = 8,5 лог.ед. |
| Вирусы | 12 мг*мин./дм3 при 0 – 5 °C; 8 мг*мин./дм3 при 10 °C; оба при pH = 7,0 – 7,5 ед.рН | 1240 мг*мин./дм3 при 1 °C; 430 мг*мин./дм3 при 15 °C; оба при pH = 6,0 – 9,0 ед.рН |
| Паразитарные простейшие – Лямблия кишечная | 230 мг*мин./дм3 при 0,5 °C; 100 мг*мин./дм3 при 10 °C; 41 мг*мин./дм3 при 25 °C; все при pH = 7,0 – 7,5 ед.рН | 2550 мг*мин./дм3 при 1 °C; 1000 мг*мин./дм3 при 15 °C; оба при pH = 6,0 – 9,0 ед.рН |
| Паразитарные простейшие – Ооцисты Криптоспоридий | Не обезвреживает | Не обезвреживает |
Как следует из таблицы 2, обеззараживающая активность хлорамина по устойчивым патогенам примерно в 10 раз ниже таковой у хлора (гипохлорит-ионов и хлорноватистой кислоты).
Итак, поскольку хлорамины обладают меньшей окислительной способностью, чем гипохлорит-ион, то:
• Взаимодействие хлорамина с органическими веществами воды с образованием ХОС происходит в гораздо меньшей степени.
• Химическое взаимодействие хлорамина с материалами водораспределительной сети происходит в гораздо меньшей степени, чем в случае с хлором, поэтому хлораммонизация воды способствует несколько меньшему коррозионному износу сетей, чем хлорирование воды без аммонизации.
• Поскольку хлорамин менее активен и на реакции с органическими веществами воды и материалами водораспределительной сети расходуется в меньшей степени, чем хлор, то хлорамин дольше сохраняет своё обеззараживающее действие, таким образом, происходит пролонгирование дезинфицирующего действия хлор-агента.
• Увеличение периода обеззараживающего действия дезинфицирующего агента является фактором против развития в водопроводной сети биоценозов, вызывающих биологическую коррозию, зарастание труб (зооглейные организмы и др.) и вторичное микробиологическое обсеменение воды.
Таким образом, аммонизация воды дает следующие преимущества:
• Приводит к снижению расхода хлора или гипохлорита натрия на 30-50%.
• Приводит к гораздо меньшему образованию в воде вредных для здоровья человека хлорорганических соединений (ХОС).
• Приводит к гораздо меньшему образованию запаховых и вкусовых хлорпроизводных.
• Увеличивает период защитного действия дезинфектанта и, следовательно, надежность сохранения качества воды по микробиологическим показателям.
• Улучшает санитарное состояние водораспределительной сети.
•Снижает коррозионную активность воды.
Доза аммония и технология его применения
При выборе дозы аммония (сульфата аммония или аммиачной воды) МДС 40-3.2000 рекомендует основываться на практике, но при проектировании реагентного хозяйства предлагает принимать весовое отношение аммонийного азота к хлору как 1 к 4 или мольное отношение азота к хлору 1 к 1,6.
Наш опыт внедрения предаммонизации воды дает оптимальное весовое отношение азота к хлору чуть ниже, в диапазоне от 1 к 4 до 1 к 7 со средним значением 1 к 5, что эквивалентно мольному отношению азота к хлору 1 к 2.
Сульфат аммония содержит 21% аммонийного азота. Весовое отношение азота к хлору 1 к 5 соответствует весовому отношению товарного сульфата аммония к хлору как 1 к 1, что весьма удобно реализовывать на практике.
Вводить сульфат аммония необходимо до введения хлора - чем раньше, тем лучше - чтобы сульфат аммония к моменту ввода хлора успел полностью перемешаться с водой.
В таблице 3 указано вторичное загрязнение воды аммонийным азотом в зависимости от дозы хлора при соотношении товарного сульфата аммония к хлору 1 к 1.
Таблица 3. Дозы сульфата аммония относительно доз хлора и загрязнение воды аммонийным азотом
| Доза хлора, мг/дм3 | Доза сульфата аммония, мг/дм3 | Содержание в воде аммонийного азота от применения аммонизации, мг/дм3 |
| 1,0 | 1,0 | 0,21 |
| 2,0 | 2,0 | 0,42 |
| 3,0 | 3,0 | 0,63 |
| 4,0 | 4,0 | 0,84 |
| 5,0 | 5,0 | 1,05 |
| 6,0 | 6,0 | 1,26 |
| 7,0 | 7,0 | 1,47 |
| 8,0 | 8,0 | 1,68 |
| 9,0 | 9,0 | 1,89 |
| 10,0 | 10,0 | 2,10 |
Как видно из таблицы 3, только при очень высоких дозах хлора, в районе 10 мг/л, предаммонизация воды дает 1 ПДК аммоний-иона.
Наладка технологии предаммонизации воды
Цели наладки разбиваются на следующие задачи:
1. Определение эффективности обеззараживания воды и пролонгированности обеззараживающего эффекта при разных дозах и отношениях хлора и сульфата аммония. Влияние предаммонизации на степень сохранения остаточного содержания активного хлора по мере продвижения воды по очистным сооружениям и в распределительной сети.
2. Определение снижения хлоропоглощения воды – снижения дозы хлора – при разных дозах сульфата аммония, т.е. при разных атомных отношениях хлор/азот. Определение оптимальных с технологической и экономической точек зрения отношений доз хлора и сульфата аммония.
3. На основе найденных оптимальных отношений реагентов и многолетней статистики по расходованию хлора на ВОС определяется годовая потребность в хлоре и в сульфате аммония для очистных сооружений, осуществляется технико-экономическое обоснование технологии аммонизации.
4. Определение степени снижения концентрации в воде галогенорганических производных хлорирования при разных дозах реагентов по индикаторному веществу хлороформу. Если рН очищенной воды невысокий, ниже 7,0, то обычно проблем с хлороформом не бывает и без аммонизации. Обычно чем выше рН, тем больше хлороформа при прочих равных условиях.
Свойства сульфата аммония
Сульфат аммония применяется при производстве вискозы, в пищевой промышленности, в качестве добавки при хлорировании водопроводной воды, при очистке белков в биохимии и в качестве азотного удобрения.
Представляет собой бесцветные или слабоокрашенные прозрачные кристаллы. Запаха не имеет, не едкий, рН-нейтральный, коррозионная активность невысокая – не содержит элементов в неустойчивых степенях окисления, хлорид-ионов и других коррозионно-активных агентов, не слеживается.
Токсичность сульфата аммония низкая: LD50(крысы, орально) = 2840 мг/кг (что примерно равно токсичности поваренной соли – LD50 = 3000 мг/кг).
В пищевой промышленности применяется как пищевая добавка E517 в качестве заменителя поваренной соли и в роли улучшителя качества муки и хлебобулочных изделий, увеличивая их объем; является азотным питанием для дрожжевых культур в гидролизных производствах; применяется как стабилизатор и эмульгатор.
ООО "НПО "Завод химических реагентов" производит сульфат аммония очищенный по ТУ 2141-001-47706948-2014, с физико-химическими характеристиками и описанием товара можно ознакомиться в разделе "Продукция". Аммоний сернокислый всегда в наличии на складе, вы можете получить дополнительную консультацию по его применению по телефону +7 (4852) 67-44-80, 67-44-81, 67-44-82.